Miembros de grupo 10°4
Edison Arrieta
Jorge Pimienta
Sergio Tapia
Jose Fabregas
Steven Visbal
Hernan Reales
miércoles, 7 de noviembre de 2012
martes, 6 de noviembre de 2012
Reacciones de Sustitucion
Reacción de sustitución simple
En una reacción de desplazamiento simple, un ion (o átomo) de un compuesto se reemplaza por un ion (o átomo) de otro elemento:
A + BC => AC + B
Un ejemplo de este tipo de reacción se evidencia cuando el hierro(Fe) desplaza al cobre(Cu) en el sulfato de cobre (CuSO4):
Fe + CuSO4 → FeSO4 + Cu
Reacción de sustitución doble
En una reacción de sustitución doble, partes de dos compuestos cambian de lugar apra formar dos nuevos compuestos. Esto es cuando los aniones y cationes de dos diferentes moléculas cambian lugares, formando dos enteramente diferentes compuestos. Estas reacciones son generalmente en esta forma
AB + CD => AD + CD
Un ejemplo de la sustitución doble es cuando el sodio (Na) en el hidróxido de sodio (NaOH) cambia lugares con el hidrógeno (H) en el ácido clorhídrico (HCl):
NaOH + HCl → NaCl + H2O
Reacciones de sintesis
En este tipo de reacciones, se combinan dos o más sustancias que pueden ser elementos o compuestos para formar un producto. Las reacciones de este tipo se clasifican como de combinación o síntesis, y se representan de forma general de la siguiente manera:
A + B = AB
Donde A y B son los reactivos y AB es el producto
Entre las reacciones de combinación tenemos las siguientes posibilidades:
- Metal + no metal => compuesto binario (óxido, sulfuro o haluro)


- No metal + oxígeno => óxido de no metal

- Oxido de metal + agua =>hidróxido de meta l

- Oxido de metal + agua=> oxácido


- Oxido de metal + óxido de no metal =>sal

Metodo de balanceo de ecuaciones por Ion-elcetron
Método ion-electrón (medio básico)
b) Medio básico
1. En el medio básico los dos primeros pasos son los mismos que para el medio ácido
SO3 -2 + MnO4- + H2O --------> MnO2 + SO4 -2 + OH-
2. Anotar las semi-reacciones de reducción y de oxidación
SRR: MnO4- -------> MnO2
SRO: SO3 -2 -------> SO4 -2
3. Para igualar los átomos de oxígeno se agregan tantas moléculas de agua como oxígenos falten, pero se agregan en el lado de la ecuación en el cuál existe una mayor cantidad de oxígeno.
MnO4- + 2 H2O --------> MnO2
SO3 -2 --------> SO4-2 + H2O
4. Los átomos de hidrógenos se equilibran con grupos hidroxilos (OH-)
MnO4- + 2 H2O --------> MnO2 + 4 OH-
SO3 -2 + 2OH- --------> SO4-2 + H2O
5. Las cargas eléctricas equilibran con electrones
MnO4- + 2 H2O + 3e- --------> MnO2 + 4 OH-
SO3 -2 + 2OH- --------> SO4-2 + H2O + 2e-
6. Como la cantidad de electrones debe ser igual en las semi-reacciones oxidante y reductora, se deben amplificar cada una por un valor determinado para igualar la cantidad de electrones:
MnO4- + 2 H2O + 3e- --------> MnO2 + 4 OH- /x2
SO3 -2 + 2OH- --------> SO4-2 + H2O + 2e- /x3
_______________________________________
2MnO4- + 4H2O + 6e- --------> 2MnO2 + 8OH-
3SO3 -2 + 6OH- --------> 3SO4-2 + 3H2O + 6e-
7. se suman ambas semi-reacciones:
2MnO4- + 4H2O + 6e- --------> 2MnO2 + 8OH-
3SO3 -2 + 6OH- --------> 3SO4-2 + 3H2O + 6e-
___________________________________________
2MnO4- + H2O + 3SO3-2 --------> 2MnO2 + 2OH- + 3SO4-2
1. En el medio básico los dos primeros pasos son los mismos que para el medio ácido
SO3 -2 + MnO4- + H2O --------> MnO2 + SO4 -2 + OH-
2. Anotar las semi-reacciones de reducción y de oxidación
SRR: MnO4- -------> MnO2
SRO: SO3 -2 -------> SO4 -2
3. Para igualar los átomos de oxígeno se agregan tantas moléculas de agua como oxígenos falten, pero se agregan en el lado de la ecuación en el cuál existe una mayor cantidad de oxígeno.
MnO4- + 2 H2O --------> MnO2
SO3 -2 --------> SO4-2 + H2O
4. Los átomos de hidrógenos se equilibran con grupos hidroxilos (OH-)
MnO4- + 2 H2O --------> MnO2 + 4 OH-
SO3 -2 + 2OH- --------> SO4-2 + H2O
5. Las cargas eléctricas equilibran con electrones
MnO4- + 2 H2O + 3e- --------> MnO2 + 4 OH-
SO3 -2 + 2OH- --------> SO4-2 + H2O + 2e-
6. Como la cantidad de electrones debe ser igual en las semi-reacciones oxidante y reductora, se deben amplificar cada una por un valor determinado para igualar la cantidad de electrones:
MnO4- + 2 H2O + 3e- --------> MnO2 + 4 OH- /x2
SO3 -2 + 2OH- --------> SO4-2 + H2O + 2e- /x3
_______________________________________
2MnO4- + 4H2O + 6e- --------> 2MnO2 + 8OH-
3SO3 -2 + 6OH- --------> 3SO4-2 + 3H2O + 6e-
7. se suman ambas semi-reacciones:
2MnO4- + 4H2O + 6e- --------> 2MnO2 + 8OH-
3SO3 -2 + 6OH- --------> 3SO4-2 + 3H2O + 6e-
___________________________________________
2MnO4- + H2O + 3SO3-2 --------> 2MnO2 + 2OH- + 3SO4-2
Método íon- electrón (medio ácido)
Generalmente este método se utiliza para ajustar ecuaciones iónicas en disolución acuosa teniendo en cuenta si el medio en que se realiza es ácido o básico.
a) Medio ácido:
1. Escribir la ecuación general que representa el cambio químico
HNO3 + H2S --------> NO + S + H2O
2. Escribir las semireacciones. El elemento no debe ser escrito como átomos o iones libres, a menos que existan como tales en solución.
SRR: NO3- -------> NO
SRO: H2S ---------S
3. Balancear cada ecuación parcial en el número de átomos de cada elemento. En disoluciones neutras o ácidas se equilibran los oxígenos agregando tantas moléculas de agua como oxígeno que falte.
NO3- -------> NO + 2 H2O
H2S ---------> S
4. Balancear cada ecuación en cuanto al número de átomos de hidógeno agregando tantos protones como hidrógenos falten.
NO3- + 4H+ --------> NO + 2 H2O
H2S ---------> S + 2H+
5. Igualar las semi-reacciones en cuanto a las cargas, utilizando los electrones (e-)
NO3- + 4H+ + 3e- -------> NO + 2H2O
H2S ---------> S + 2H+ + 2e-
6. Amplificar cada ecuación para que la cantidad de electrones cedidos y ganados sean iguales.
NO3- + 4 H+ + 3 e- --------> NO + 2H2O /x2
H2S -----------> S + 2H+ + 2e- /x3
_____________________________________
2NO3- + 8H+ + 6 e- -------> 2NO + 4 H2O
3H2S --------> 3S + 6H+ + 6e-
7. sumar algebraicamente ambas semi-reacciones
2NO3- + 8H+ + 6e- --------> 2NO + 4 H2O
3H2S -----------> 3S + 6 H+ + 6 e-
_______________________________________
2NO3- + 3H2S + 2H+ --------> 2NO + 3S + 4 H2O
8. Colocar los coeficientes en la ecuación general
2HNO3 + 3H2S ---------> 2NO + 3S + 4H2O
a) Medio ácido:
1. Escribir la ecuación general que representa el cambio químico
HNO3 + H2S --------> NO + S + H2O
2. Escribir las semireacciones. El elemento no debe ser escrito como átomos o iones libres, a menos que existan como tales en solución.
SRR: NO3- -------> NO
SRO: H2S ---------S
3. Balancear cada ecuación parcial en el número de átomos de cada elemento. En disoluciones neutras o ácidas se equilibran los oxígenos agregando tantas moléculas de agua como oxígeno que falte.
NO3- -------> NO + 2 H2O
H2S ---------> S
4. Balancear cada ecuación en cuanto al número de átomos de hidógeno agregando tantos protones como hidrógenos falten.
NO3- + 4H+ --------> NO + 2 H2O
H2S ---------> S + 2H+
5. Igualar las semi-reacciones en cuanto a las cargas, utilizando los electrones (e-)
NO3- + 4H+ + 3e- -------> NO + 2H2O
H2S ---------> S + 2H+ + 2e-
6. Amplificar cada ecuación para que la cantidad de electrones cedidos y ganados sean iguales.
NO3- + 4 H+ + 3 e- --------> NO + 2H2O /x2
H2S -----------> S + 2H+ + 2e- /x3
_____________________________________
2NO3- + 8H+ + 6 e- -------> 2NO + 4 H2O
3H2S --------> 3S + 6H+ + 6e-
7. sumar algebraicamente ambas semi-reacciones
2NO3- + 8H+ + 6e- --------> 2NO + 4 H2O
3H2S -----------> 3S + 6 H+ + 6 e-
_______________________________________
2NO3- + 3H2S + 2H+ --------> 2NO + 3S + 4 H2O
8. Colocar los coeficientes en la ecuación general
2HNO3 + 3H2S ---------> 2NO + 3S + 4H2O
Método de balanceo de ecuaciones por tanteo o inspección
Se efectúa por simple inspección visual. Se recomienda para balancear ecuaciones sencillas, generalmente para ecuaciones con cuatro sustancias químicas.
Proceso: Se observa que elementos no están igualados en su número de átomos en ambos lados de la ecuación química y se procede a balancearlos colocando delante de las fórmulas o símbolos de las sustancias el coeficiente mas conveniente; si no resulta el balance, deberá intentarse con otros coeficientes hasta que se logre la igualdad de los atomos de todos los elementos.
Para balancear de manera eficaz por tanteo, es recomendable seguir el siguiente orden general de balanceo de los elementos.
| Elemento | Metal | No Metal | H | O |
| Orden | 1ro | 2do | 3er | 4to |
Ejemplo 1: Balancear la siguiente ecuación química:
H3PO4 + Cu (OH)2 → Cu3 (PO4)2 + H2O
- De acuerdo a la tabla dada, en primer lugar balanceamos los metales (en este caso el cobre: Cu). Tenemos:
Cu (OH)2 → Cu3 (PO4)2
- En los productos tenemos 3 átomos de cobre, en los reactantes solo tenemos 1 átomo de cobre, entonces colocamos el coeficiente 3 delante del Cu(OH)2 , quedaría así:
3Ca (OH)2 → Ca3 (PO4)2
- Completamos la ecuación:
H3PO4 + 3Cu (OH)2 → Cu3 (PO4)2 + H2O
- Luego Nos disponemos a balancear el fósforo, colocando el coeficiente 2 delante de H3PO4
2H3PO4 + 3Cu (OH)2 → Cu3 (PO4)2 + H2O
- Balanceamos los hidrógenos. En los reactantes tenemos:
2H3PO4 = 6 hidrógenos
3Cu (OH)2 = 6 hidrógenos
TOTAL = 12 Hidrógenos
- Balanceamos los hidrógenos. En los productos tenemos:
H2O = 2 hidrógenos
por lo tanto hay que ponerle el coeficiente 6 delante del H2O , quedando así:
6 H2O = 12 hidrógenos (balanceado con los reactantes)
- La ecuación quedaría:
2H3PO4 + 3Cu (OH)2 → Cu3 (PO4)2 + 6 H2O
- Los oxígenos en los reactantes:
2H3PO4 = 8 oxígenos
3Cu (OH)2 = 6 oxígenos
TOTAL = 14 Oxígenos
- Los oxígenos en los productos:
Cu3 (PO4)2 = 8 oxígenos
6 H2O = 6 oxígenos
TOTAL = 14 Oxígenos (ya está balanceado)
- La ecuación balanceada será:
2H3PO4 + 3Cu (OH)2 → Cu3 (PO4)2 + 6 H2O
Ejemplo 2: Balancear por tanteo o simple inspección:
C2H2 + O2 → CO2 + H2O
La solución sería:
2C2H2 + 5O2 → 4CO2 + 2H2O
Ejemplo 3: Balancear por tanteo o simple inspección:
N2 + H2 → NH3
La solución sería:
N2 + 3H2 → 2NH3
Ejemplo 4: Balancear por tanteo o simple inspección:
C5H12 + O2 → CO2 + H2O
La solución sería:
C5H12 + 8O2 → 5CO2 + 6H2O
Reacciones por oxido-reducción (redox)
http://www.fullquimica.com/2011/12/reacciones-redox.html

También llamados reacciones de reducción y oxidación. Son aquellas que ocurren mediante transferencia de electrones, por lo tanto hay sustancias que pierden electrones (se oxidan) y otras que ganan electrones (se reducen)
La gran mayoría de reacciones que son de interés, en quimica son reacciones de reducción y oxidación, comoejemplos tenemos: la combustión de los hidrocarburos, la acción de los agentes blanqueadores de uso domestico, la obtención de los metales a partir de sus minerales, el proceso de respiración, proceso de digestión, reacción que ocurre en la pila seca y baterías, etc..
Oxidación. Es el fenómeno mediante el cual una especie química pierde electrones, por lo tanto el número de oxidación (N.O.) aumenta algebraicamente porque pierde carga negativas.
Ejemplos:

Reducción. Es el fenómeno mediante el cual una especie química gana electrones, por lo tanto el número de oxidación (N.O.) disminuye algebraicamente porque gana carga negativas.
Ejemplos:
El agente oxidante, es la sustancia química que al reducirse provoca la oxidación de otro; por lo tanto lasustancia que se reduce es agente oxidante.
El agente reductor, es la sustancia quimia que al oxidarse provoca o causa la reducción de otro; por lo tanto lasustancia que se oxida es agente reductor.
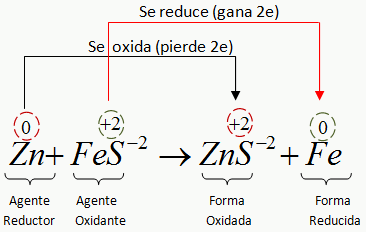
A continuación se ilustra en forma resumida una reacción redox:

Descripción del Proceso:
El átomo neutro del Zn (Zn0) pierde 2 electrones y se convierte en ion cinc (Zn+2) según la siguiente reacción: Zn0→ Zn+2 + 2e- ………………. semireacción de oxidación
Los dos átomos que pierde el Zn es ganado por el ión ferroso (Fe+2) para convertirse en atomo neutro (Fe0) Fe+2 + 2e- → Fe0 ……………….. semireacción de reducción
El ión Zn+2 es forma oxidada del Zn0 y el Fe0 es la forma reducida del Fe+2
El sulfuro ferroso FeS, se llama oxidante porque contiene al ión Fe+2 , que al reducirse provoca la oxidación del Zn. Al sulfuro de Zinc, ZnS, se le llama forma oxidada porque contiene al Zn+2 que es la forma oxidada del Zn0
Reacciones de descomposición
Reacciones de descomposicion
Descomposición
En este tipo de reacciones químicas partimos de un solo reactante para descomponerlo en dos o más productos, por medio de un agente energético externo o un catalizador:
- Si la energía es calorífica se llama pirólisis, es la descomposición por calentamiento a altas temperaturas.
- Si la descomposición es por acción de la luz se llama fotólisis
- Si la descomposición es por acción de un catalizador se llama catálisis.
- Si la descomposición es por medio de la corriente eléctrica, se llama electrólisis.

Sales

- Resultan de reaccionar un ácido o una base
- Son saladas
- Compuestos orgánicos e inorgánicos
- Si se disuelven en agua conducen electricidad
- En general, las sales son compuestos iónicos que forman cristales. Son generalmente solubles en agua, donde se separan los dos iones. Las sales típicas tienen un punto de fusión alto, baja dureza, y baja compresibilidad. Fundidos o disueltos en agua, conducen la electricidad.
- Son formadas por cationes enlazados con aniones
En caso de ser una sal binaria el anión (ácido binario) cambia el sufijo -hidrico por el sufijo -uro y se agrega el nombre del cation.
Ejemplo: Cloruro de sodio- Sulfuro de hierro
Cuando son sales ternarias (anión es un ácido ternario) los sufijos -oso e -ico cambian a -ito y -ato respectivamente. Exites dos casos posibles en una sal ternaria
- Sal o ternaria neutra: se sustituyen todos los hidrógenos.
Ejemplo: Hipoclorito de sodio = NaClO.
Carbonato de calcio = CaCO3
- Sal ácida: se sustituyen parte de los hidrógenos.
Hidrogenosulfato de potasio o disulfato de potacio, KHSO4
Acidos


Los ácidos son compuestos que se originan por combinación del agua con un anhídrido u óxido ácido, o bien por disolución de ciertos hidruros no metálicos en agua. En el primer caso se denominan oxácidos y en el segundo, hidrácidos. Ácido, también es toda sustancia que en solución acuosa se ioniza, liberando cationes de hidrógeno.
En caso de que el ácido sea un compuesto Binario se nombra con la raíz del elemento al comienzo seguida del sufijo -hidrico.
Ejemplo: Ácido Clorhídrico- Ácido Sulfurhidrico
Si es un compuesto ternario se utiliza solamente la nomenclatura tradicional para nombrarlos.
Ejemplo: Ácido Sulfúrico- Ácido Fosforoso
Bases o Hidroxidos

Los hidróxidos son un grupo de compuestos químicos formados por un metal y uno o varios aniones hidroxilos, en lugar de oxígeno como sucede con los óxidos.
El hidróxido, combinación que deriva del agua por sustitución de uno de sus átomos de hidrógeno por un metal, está presente en muchas bases.
Los hidróxidos resultan de la combinación de un óxido básico con el agua. Los hidróxidos también se conocen con el nombre de bases. Estos compuestos son sustancias que en solución producen iones hidroxilo.
Para nombrar los hidróxidos se pueden utilizar las 3 nomenclaturas las stock, la sistemática y la tradicional.
Oxidos

Un óxido es un compuesto binario que contiene uno o varios átomos de oxígeno (el cual,normalmente, presenta un estado de oxidación -2) y otros elementos. Existe una gran variedad de óxidos,los cuales se presentan en los 3 principales estados de agregación de la materia: sólido,líquido y gaseoso, a temperatura ambiente. Casi todos los elementos forman combinaciones estables con oxígeno y muchos en varios estados de oxidación. Debido a esta gran variedad las propiedades son muy diversas y las características del enlace varían desde el típico sólido iónico hasta los enlaces covalentes.
Existen dos tipos de óxidos.
- Los óxidos básicos se forman con un metal más oxígeno, los óxidos de elementos menos electronegativos tienden a ser básicos.
- Los óxidos ácidos son los formados con un no metal + oxígeno, los óxidos de elementos más electronegativos tienden a ser ácidos.
Los oxidos se pueden nombrar mediante las 3 nomenclaturas que exites de compuestos inorganicos: la sistematica, Stock, y tradicional
Nomenclatura Quimica
En un sentido amplio, nomenclatura química son las reglas y regulaciones que rigen la designación (la identificación o el nombre) de las sustancias químicas.
Como punto inicial para su estudio es necesario distinguir primero entre compuestos orgánicos e inorgánicos.
Los compuestos orgánicos son los que contienen carbono, comúnmente enlazado con hidrógeno, oxígeno, boro, nitrógeno, azufre y algunos halógenos. El resto de los compuestos se clasifican como compuestos inorgánicos. Éstos se nombran según las reglas establecidas por la IUPAC.
Nomenclatura inorganica
Los compuestos inorgánicos se clasifican según la función química que contengan y por el número de elementos químicos que los forman, con reglas de nomenclatura particulares para cada grupo. Una función química es la tendencia de una sustancia a reaccionar de manera semejante en presencia de otra. Por ejemplo, los compuestos ácidos tienen propiedades características de la función ácido, debido a que todos ellos tienen el ion hidrógeno H+1; y las bases tienen propiedades características de este grupo debido al ion OH-1 presente en estas moléculas. Las principales funciones químicas son: óxidos, bases, ácidos y sales.
Se aceptan tres tipos de nomenclaturas para nombrar compuestos químicos inorgánicos:
- La Nomenclatura Sistematica
- La Nomenclatura Stock
- La Nomenclatura Tradicional
- Nomenclatura Sistemática
| Prefijos griegos | numero de atomos |
| mono- | 1 |
| di- | 2 |
| tri- | 3 |
| tetra- | 4 |
| penta- | 5 |
| hexa- | 6 |
| hepta- | 7 |
| oct- | 8 |
| non- nona- eneá- | 9 |
| deca- | 10 |
2. Nomenclatura Stock
Este sistema de nomenclatura se basa en nombrar a los compuestos escribiendo al final del nombre con números romanos la valencia atómica del elemento con “nombre específico”.De forma general, bajo este sistema de nomenclatura, los compuestos se nombran de esta manera: nombre genérico + de + nombre del elemento específico + el No. de valencia.
Ejemplo: Oxido de hierro (III) - Hidroxido de cobre(II)
3. Nomenclatura Tradicional
En este sistema de nomenclatura se indica la valencia del elemento de nombre específico con una serie de prefijos y sufijos. De manera general las reglas son:
- Cuando el elemento sólo tiene una valencia, simplemente se coloca el nombre del elemento precedido de la sílaba “de” y en algunos casos se puede optar a usar el sufijo –ico.
Oxido de Potasio
- Cuando tiene dos valencias diferentes se usan los sufijos -oso e -ico.
-
- … -oso cuando el elemento usa la valencia menor
- … -ico cuando el elemento usa la valencia mayor
Oxido Ferroso - Oxido Férrico
- Cuando tiene tres distintas valencias se usan los prefijos y sufijos.
-
- hipo- … -oso cuando el elemento usa la valencia menor
- … -oso cuando el elemento usa la valencia intermedia
- … -ico cuando el elemento usa la valencia mayor
- Oxido Hipofosforoso- Oxido Fosforoso- Oxido Fosforico
- Cuando entre las valencias se encuentra el 7 se usan los prefijos y sufijos.
… -oso (para la valencias 3 y 4)
… -ico (para la valencias 5 y 6)
per- … -ico (para la valencia 7):
Oxido Hipocloroso- Oxido Cloroso- Oxido Clórico- Oxido Perclorico
lunes, 5 de noviembre de 2012
Para conocer acerca de la química, primero debemos saber la definición del concepto.
Que es la química?
La química, es una ciencia empírica. Ya que estudia las cosas, por medio del método científico. O sea, por medio de la observación, la cuantificación y por sobretodo, la experimentación. En su sentido más amplio, la química, estudia las diversas sustancias que existen en nuestro planeta. Asimismo, las reacciones, que las transforman, en otras sustancias. Como por ejemplo, el paso del agua líquida, a la sólida. O del agua gaseosa, a la líquida. Por otra parte, la química, estudia la estructura de las sustancias, a su nivel molecular. Y por último, pero no menos importante, sus propiedades.
Su historia.
Los primeros hombres, en trabajar y estudiar las distintas sustancias, fueron los alquimistas, los cuales entre los siglos III a.c. y el siglo XVI d.c, tendieron a buscar el método de transformar los metales, en oro. Esto, por medio de la búsqueda frenética e incansable de la piedra filosofal. Tipo de elixir, que lograría que la fusión del mercurio con el azufre, fuera un éxito.Ellos comenzaron a desarrollar, las dos ramas iniciales, que se mantienen hasta hoy. La primera, es la química orgánica. Que estudia las sustancias basadas en la combinación de los átomos de carbono e incluye a los hidrocarburos y sus derivados, los productos naturales, finalizando con los tejidos vivos.Luego, en los siglos XVI y XVII, la química se comenzó a desarrollar como tal. Ya para el siglo XVIII, la química se había transformado en una ciencia empírica. O sea, se comenzó a utilizar en ella, el método científico. Sobretodo, la experimentación.
La otra rama de la química, es la inorgánica. La cual versa en el estudio de los minerales terrestres.
Claro que estas dos ramas, se han ido desvaneciendo con el tiempo. Debido al desarrollo mismo de la química y el ingreso progresivo de la biología, al campo de la primera.
Suscribirse a:
Entradas (Atom)



_523.2.jpg)

